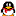一般制药生产车间纯化水以饮用水为原水,经多介质过滤器、活性炭过滤器、软化器处理制备的纯化水,采用RO+EDI处理,有不合格水直接排放功能,合格水经储罐进入循环状态,供给洁净区内各使用点。系统循环回水安装有在线电导率、在线TOC检测装置,循环系统在运行时流速不低于1m/s,循环回水温度在线显示,对于长期不用的水,系统周期的置换。
纯化水系统验证分三个阶段进行,在前两个阶段,每天对纯化水贮罐、总送水口、总回水口、各使用点取样,进行水质检测;第三个阶段持续一年的时间,每周对制备系统出水口、总送水口、总回水口取样,每月对所有用点轮流取样。
但《2003版验证指南》第106页指出,“纯化水初期验证取样频率取样点为,纯化水贮罐、总送水口、总回水口、各使用点,前3个周期天天取样,并记录水温。各使用点前3个周期每个周期取样,并记录水温。”
知其然我们还要知其所以然,针对储罐取样点的必要性和位置的合理性,我们从以下几个方面分析:
1在储罐取样的原因
《药品生产验证指南(2003版)》编写依据为1998版GMP,当时的制药企业的水系统多为批量式,针对这种情况,作为通用的验证指南,储罐的取样点很必要,因为批量式的储罐,在长期生产用水量小的情况下,储罐内水为相对静止,为最差条件点,应该定期检测,并保证水质合格。
但是目前科学技术发展的今天,水系统设计为不间断循环形式,且储罐进水有喷淋装置,保证储罐内无死角。此时的储罐内的水是流动的,从风险评估角度分析,水系统的回水点则应为系统内的水质风险点。因为水系统相对运动,在新水制备时,储罐是系统内水被稀释,水质最好;在水系统循环过程中,用点被污染时,被污染的水进入系统,储罐是污染被稀释的点。基于以上认识,储罐的取样点在这样的水系统中,风险就不大了。
2 取样点的设置原则
2010版的实施指南《厂房设施与设备》引用了ASME BPE2009中的SD-4.11.6的原文
“ASME BPE2009
SD-4.11.6 Critical Design Criteria for Point-of-Use Assemblies
(d) Sample valves should be integral to the design of the primary valve in order to reduce dead legs in the system.
(e) Sample valves should be installed only as needed on the main loop.
(f) Sample valves should be installed where water is utilized for the process to demonstrate water quality compliance to compendial monographs.
取样阀的设置需要注意到:
取样阀的设置应当采用与主阀门一体的阀或注意与管道的连接,避免出现死角。
主循环的取样阀只在需要时设置。
取样阀应当安装在需证明水质符合药典要求的位置。”
3 储罐的形式与储罐取样点设置位置的联系
目前储罐的取样点大多选择在罐体中部,立罐在中间靠下处,卧罐在与封口水平处,对于自动化控制的循环系统,泵的停止运行液位设置一般为20%,如罐体内纯化水液位在20%~30%之间,取样人员贸然打开取样阀门,会使外界未经除菌过滤的空气进入罐体,造成污染,这样的风险也是很大的。
如纯化水储罐是立罐,则罐体底部横截面积较小,最低点应为储罐内最恶劣位置,出水管路也在该位置,那取样点应在何位置设置?(取样点应在系统最恶劣点。)
如纯化水储罐是卧罐,则罐体安装时应有坡度,罐体最低点应为罐体低平面与封头接口位置,该处设置取样点取样可执行性不强。
通过示意图看出,如果取样点不在罐体底部,则该点所取的样品不是最能代表储罐最恶劣点的,在该点位取样的意义就不大。
通过以上分析,我们可以得出这样的结论,制药用水系统必须经过验证其能提供符合药典要求的水,验证时对于取样点的选择是要通过风险分析确定的,而不是仅按照一些指南规定的生搬硬套,要是能证明系统能力的点位,这样才能为是药品的生产提供强有力的支持。
参考文献
[1]《药品生产验证指南(2003版)》国家食品药品监督管理局药品认证管理中心.
[2]2010版的实施指南《厂房设施与设备》国家食品药品监督管理局药品安全监管司、药品认证管理中心组织编写.
[3]ASME BPE 2009.The American Society of Mechanical Engineers.
版权声明:因本文均来自于网络,如果有版权方面侵犯,请及时联系本站删除.